ABD’de Alzheimer ilacına geniş kapsamlı onay
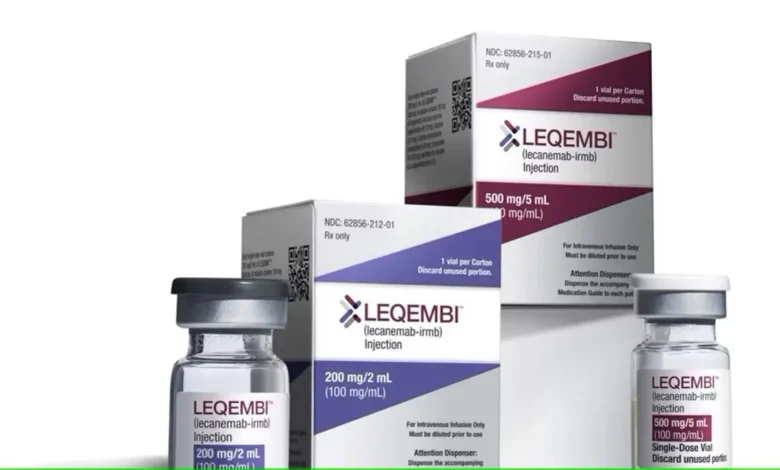
Eisai ve Biogen firmalarının Alzheimer ilacı Leqembi’ye ABD Gıda ve İlaç İdaresi’nden (FDA) beklenen onay verildi. FDA’in ‘’standart onayı’’nı alabilen ilk Alzheimer tedavisi için daha geniş sigorta kapsamının da önü açıldı.
FDA kararı, onlarca yıldır ilaç üreticilerinin çabalarını boşa çıkaran ölümcül hastalık için yeni bir kilometre taşına işaret ediyor. Klinik deneylerin verileri, tedavinin Alzheimer’ın en erken evrelerindeki hastalarda beyni tahrip eden hastalığın ilerlemesini yüzde 27 oranında yavaşlattığını gösteriyor.
FDA ayrıca Leqembi’nin prospektüsüne, aynı sınıftaki Alzheimer ilaçları için potansiyel olarak tehlikeli beyin şişmesi riskini işaret eden en güçlü güvenlik uyarısını yerleştirdi.
Analistlerin güvenlik uyarısını olumsuz bir sürpriz olarak nitelendirmesiyle Eisai hisseleri bugün Tokyo’da düşüşe geçti.
VOA Türkçe’nin haberinde, Japon ilaç firması Eisai’nin Amerikalı ortağı Biogen ile beraber geliştirdiği Alzheimer ilacı, beyindeki beta-amiloid adlı yapışkan proteini hedef alıp temizlemek için tasarlandı. Beta-amiloid, beyni tıkayan plak birikintilerine yol açıyor. Bu birikintiler, Alzheimer hastalığının kilit özelliklerinden biri.
Leqembi, amiloid temizleme kabiliyetine dayanarak Ocak ayında “hızlandırılmış” FDA onayı almış, ancak ABD hükümetinin 65 yaş ve üstü kişilere yönelik Medicare sağlık planı, kapsamı yalnızca bir klinik çalışmadaki hastalarla sınırlandırmıştı.
Standart onay, Leqembi’nin artık her hasta için sigorta kapsamında olacağı anlamına geliyor. Medicare ve Medicaid Hizmet Merkezleri (CMS) hastalara geri ödemeyi, bir sağlık kurumu veri tabanında kayıt altında olmalarına bağlıyor. Alzheimer, yaşlılıkla ilgili olduğundan, ABD’deki hastaların çoğunun Medicare sigortası mevcut. Damardan verilen Leqembi’nin ABD liste fiyatı yıllık 26 bin 500 dolar.
Cleveland Clinic’te Leqembi klinik deneylerinin araştırmaları yürüten Dr. Babak Tousi, tedaviye çok fazla ilgi beklediğini, ancak 10 hastadan sadece 1’inin ilacı almaya uygun aşamada olacağını tahmin ettiğini söyledi.
Tousi, Leqembi’nin “bir tedavi olmadığını” ve hastalıkta zamanı geri döndürmeyeceğini, sadece ilerlemeyi yavaşlatacağını hatırlattı.
Yeni prospektüste önemli uyarı
Leqembi’nin yeni prospektüsünde amiloid düşürücü antikorlarla ilişkili potansiyel olarak tehlikeli beyin şişmesi ve kanaması için hastaların izlenmesi gerektiğine dikkat çekiyor. Alzheimer ile ilişkili bir gen olan APOE4’ün iki kopyasına sahip hastalarda riskin daha yüksek olduğu ve genetik testin şiddetle tavsiye edilmesine rağmen gerekli olmadığı da belirtiliyor.
Yeni prospektüs, Leqembi ile birlikte belirli kan sulandırıcı ilaçların kullanımının beyin kanaması riskiyle bağlantılı olduğunu gösteren verileri de içeriyor.
Eisai’nin hisseleri Tokyo borsasında yaklaşık yüzde 5 düştü. Ancak hisseler geçen yıl yaklaşık yüzde 50 değer kazandı.
Uzmanlar, FDA’in prospektüse uyarı koyma yönündeki beklenmedik kararının ilacın satış büyümesinin yavaşlamasıne neden olacağını belirtti; genetik test önerisinin potansiyel hastalar için maliyetleri arttıracağını kaydetti.
Ancak Eisai CEO’su Haruo Naito Tokyo’da gazetecilere yaptığı açıklamada, ABD sağlık sigortasının çok uzak olmayan bir gelecekte genetik testler dahil tüm tedavi sürecini karşılayacağına inandığını söyledi.
Naito ayrıca ilacın Eylül ayı sonuna kadar Japonya’da onay alma yolunda ilerlediğini kaydetti.
Mayıs ayında yayınlanan bir basın açıklamasına göre, güvenlik uyarısı Eli Lilly firmasının donanemab adlı deneysel Alzheimer ilacı için de geçerli olacak. Bu ilacın, ileri evre çalışmada bilişsel gerilemeyi yüzde 35 oranında yavaşlattığı açıklanmıştı. Çalışmanın tam sonuçlarının bu ay içinde alınması bekleniyor.
Eisai, sağlık merkezlerini Leqembi’yi kullanmaya hazır hale getirme çabalarını genişlettiğini açıkladı; ancak şu ana kadar kaç hastanın ilaçla tedavi edildiği konusunda bilgi vermedi.
ABD Alzheimer Derneği’ne göre 6 milyondan fazla Amerikalı Alzheimer hastası. Eisai, amiloid düşürücü ilaçların Leqembi’nin piyasadaki ilk üç yılında yaklaşık 100 bin ABD’li hastada kullanılacağını tahmin ediyor.
FDA onaylı ilk hastalık modifiye edici Alzheimer ilacı olan Aduhelm de Eisai ve Biogen ortaklığında geliştirildi; ancak Medicare kapsam kısıtlamaları kullanımını ciddi şekilde sınırladı.
Eisai, ABD ve Japonya dışında Leqembi için Avrupa Birliği, Çin, Kanada, İngiltere ve Güney Kore’de de onay almaya çalışıyor. Japonya’da olduğu gibi Çin’de de başvurunun öncelikli olarak incelenmesine karar verildi.